DNA 序列转化为完全正确折叠的蛋白质产物的过程极为复杂,涉及转录、翻译、翻译后修饰、蛋白质折叠和最终分泌等数个步骤,其中任何一个步骤出现问题均能影响蛋白质的表达[1],进而导致蛋白降解、聚集及引起细胞毒性等 [1]。
通常,对于候选治疗性蛋白药物,尤其是单、双抗药物的设计改造目的主要为增加其对靶点蛋白的亲和力或改善其热稳定性,很少评估它们在宿主细胞系,例如 CHO 细胞中的表达难易程度[2]。而生物药物候选分子在开发早期的低表达量是导致产品早期开发终止的主要原因之一。
难表达治疗性蛋白通常是那些转录、翻译和折叠/组装反应速率不匹配的蛋白药物,包括类毒素、酶、膜蛋白、部分单、双抗、以及疏水性较强的蛋白质[3,4]。协调优化各种相互关联的动态过程(从基因序列到分泌蛋白)是优化产物收率的必要条件[3]。
汉腾解决方案
为解决这一难题,汉腾生物针对难表达蛋白药物开发了 DTEasy 工具箱,可集成并优化难表达蛋白表达过程中的各个关键阶段,成功提高蛋白产量,以助力蛋白药物分子顺利实现产业化。
01 分子改良策略
◽ 基于氨基酸序列分析和蛋白结构预测,通过引入点突变、优化氨基酸序列;
◽ 进行蛋白截短、融合表达标签蛋白;
◽ 筛选适合的 抗体药物VH/VL 框架对,基因工程优化重、轻链序列等;以改善蛋白的三维结构,提高蛋白热稳定性。
02 宿主选择策略
相较其它表达系统宿主,哺乳动物细胞具有更优异的蛋白质折叠和二硫键形成能力[5]。不同种类哺乳动物细胞的糖基化能力也有所不同,对于表达糖基化修饰要求较高的蛋白,如凝血因子等,可选用汉腾独家开发的GlycoExpress® (GEX)细胞系。
此外,表达一些组织特异性较高的蛋白,如G蛋白受体 (GPCR)胞外结构域, 相较于传统的CHO细胞系, 该蛋白在GEX® 细胞中的表达量可提升十倍。
03 载体优化策略
通过转录组差异表达分析,将与难表达蛋白产量正相关的顺式作用元件插入到表达载体中,选择多拷贝载体及难表达蛋白专用载体,或共表达蛋白抑制剂、配体等。
04 工艺构建
在细胞培养过程中可添加专用添加剂,针对不同的细胞制定对应的筛选以及培养工艺,以提高活细胞密度并有助于延长培养时间,最终达到提升产量的目的。DTEasy 专有添加剂可只需在培养过程中简单的单次添加,即可最高提升 3 倍表达量。汉腾生物建立的 CBoost® 加强型工艺平台,加强型补料批培养可达到超过两倍的蛋白表达量。此外,由于细胞需要平衡蛋白表达和生长,外源蛋白表达会给细胞造成较大压力[6]。针对这一特点,汉腾生物采用了更为温和的环轨摇晃式反应器,操作简便的同时,还可以缩短混合时间、降低剪切应力、减少泡沫及污染。
案例一
信号肽位于分泌蛋白的 N 端,引导新合成的蛋白质进入内质网腔.而信号肽序列则在信号肽酶的作用下被切除。信号肽筛选是增强蛋白分泌的一种重要途径。选择不同的信号肽会导致不同的融合蛋白 N 端截短比例,进而可能对融合蛋白的纯度和活性产生影响。
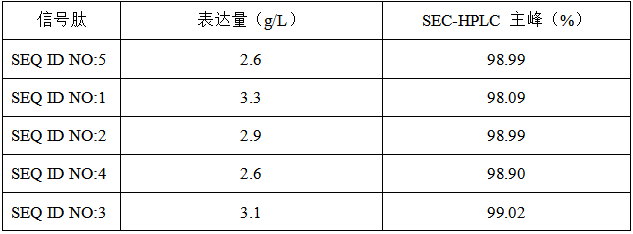
针对重组胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)项目,汉腾生物设计了多种信号肽用于增强 GLP-1 蛋白或 GLP-1 融合蛋白在宿主细胞中的表达(结果如下,详细内容参考汉腾专利:信号肽在表达GLP-1融合蛋白中的应用,CN114539357B)。通过不同信号肽的组合,药物蛋白的纯度和生物学活性得以显著提升(表 1)。
表1. 细胞培养上清中 GLP-1-Fc 融合蛋白的表达量以及纯化后融合蛋白纯度
案例二
对于某些过量表达后会引起细胞毒性的蛋白质,如蛋白酶和凝血酶,可以考虑共表达其抑制剂,减少其表达给细胞存活造成的压力,从而提高蛋白产量。
针对组织型纤溶酶源激活剂(tissue plasminogen activator,t-PA),汉腾生物构建了共表达 t‑PA 和 t‑PA 抑制剂的双表达框载体以及一步层析纯化工艺(结果如下,详细内容参考汉腾专利:t-PA纯化方法,CN14426962B)。其中 t‑PA 与 t‑PA 抑制剂形成的非共价复合物结构松散,易于分离。此外,目前 t‑PA 的纯化工艺一般需要 3~4 步才能实现 90%以上的纯度,共表达 t‑PA 抑制剂后结合使用赖氨酸亲和层析,能够实现 t‑PA 的一步层析纯化(图 1)。最终 tPA 的纯化后产率达 361.5 mg/L,是现有技术的 3 倍以上。
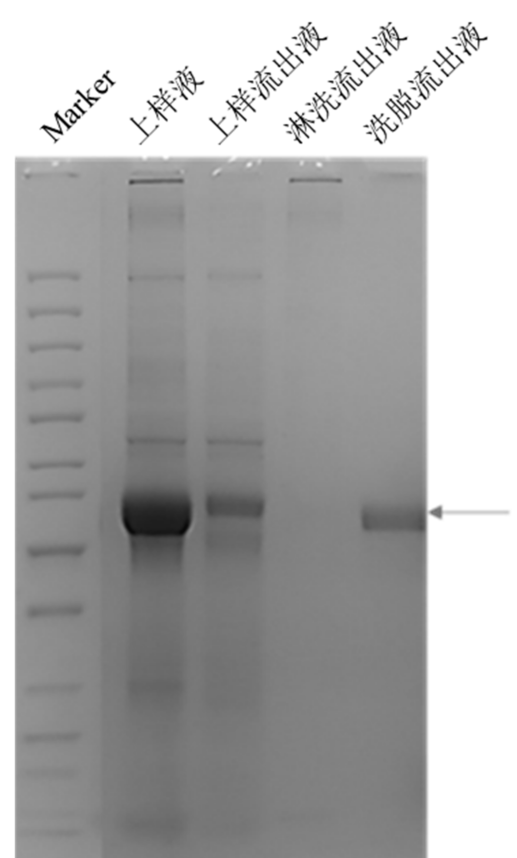
图 1. 赖氨酸亲和层析结果
案例三
商业生产中使用细胞培养生产充足蛋白质的方法主要分为三种:分批培养、补料分批培养和连续培养。分批培养方法中,所有营养物质都在初始基培养基中提供,随着培养时间延长,营养物质不断减少,乳酸等代谢抑制物增加。补料分批培养是指在培养过程中,间歇或连续地补加新鲜培养基,可以避免细胞和代谢过程中的产物以及某些营养物质的缺乏对细胞的抑制作用。连续培养是培养过程中不断灌注培养基能同时清除废物、提供营养和收获产品的培养方法。针对不同的难表达蛋白选择更合适的细胞培养方式以及额外补充专用添加剂,有助于提升蛋白产量。
此前,并无高效表达人类神经生长因子(human never growth factor,hNGF)的培养方法,极大限制了 hNGF 的大规模生产和在临床与药物方面的应用。汉腾生物采用补料分批培养方法,并发现了新的添加剂,可以将 hNGF 重组蛋白的表达量提高至少 100%,产量最高可提升至 2900 mg/L左右(图 2),较大地提升了 hNGF 在 CHO 细胞中的表达水平(详细内容参考汉腾专利:重组神经生长因子的高效表达方法,CN2023108028220)。
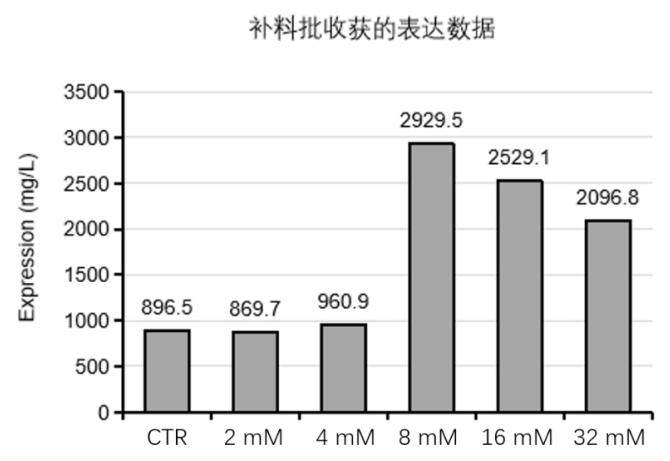
图 2. 含有不同浓度添加剂的培养基条件下 β-NGF 蛋白表达量的柱形图
案例四
搅拌式生物反应器是细胞培养领域常用的反应器,由于其搅拌桨易造成剪切力,且其深层通气方式易产生泡沫从而造成更巨大的剪接力,会对细胞造成伤害,甚至死亡。此外,搅拌式生物反应器在扩大培养过程中,由于涉及的参数较多,流体力学复杂,造成放大困难,甚至失败。
环轨摇晃式生物反应器是一种通过环轨摇晃混合方式进行细胞培养的生物反应器,可以很好地解决搅拌式生物反应器存在的问题。但由于工作原理存在较大差异,搅拌式生物反应器的培养条件并不适用环轨摇晃式生物反应器。为解决这一问题,汉腾生物成功开发了一种细胞培养的方法(详细内容参考一种使用环轨摇晃式生物反应器培养细胞的方法,CN113862224A)。该方法采用梯度增速及降温的方式培养细胞,同时对培养基进行适当优化,细胞活率以及蛋白表达量更高(图 3-4)。
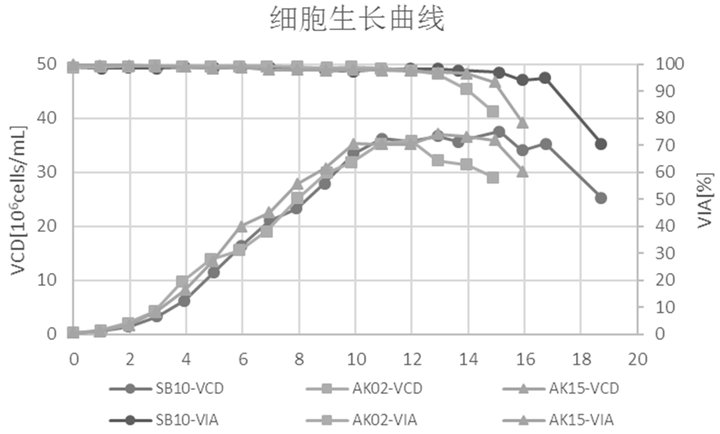
图 3. 活细胞密度(VCD)和细胞活率(VIA)。SB-10:环轨摇晃式生物反应器;AK02:3 L搅拌式生物反应器;AK15:15 L搅拌式生物反应器
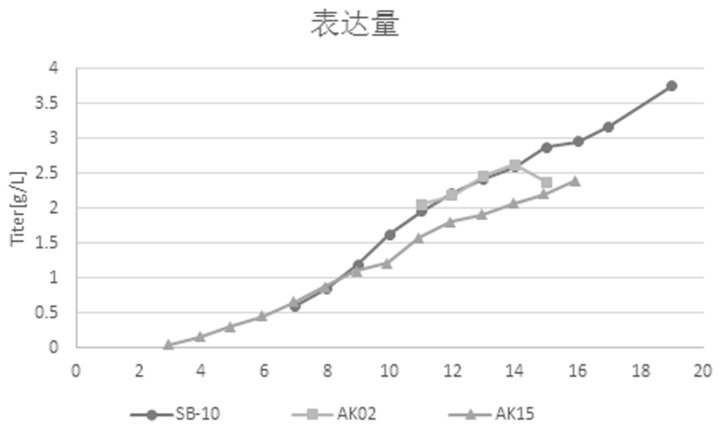
图 4. 蛋白表达量。SB-10:环轨摇晃式生物反应器;AK02:3 L搅拌式生物反应器;AK15:15 L搅拌式生物反应器
综上,汉腾DTEasy平台通过先进的分子设计、载体优化、宿主细胞系的精细筛选以及定制化工艺,成功解决了多种类型蛋白质的难表达问题,我们期待为您提供定制化服务!

扫码添加微信小助手
预约汉腾技术专家1对1沟通
汉腾专利(本文相关)
1. 信号肽在表达GLP-1融合蛋白中的应用[P].广东省:CN202011358998.4,2024-07-30.
2.t-PA纯化方法[P].广东省:CN202111574380.6,2024-06-18.
3.重组神经生长因子的高效表达方法[P].广东省:CN202310802822.0,2023-11-10.
4.一种使用环轨摇晃式生物反应器培养细胞的方法[P].广东省:CN202010618579.3,2021-12-31.
参考文献(滑动查看)


